近日,Journal of Agricultural and Food Chemistry在线发表了江南大学未来食品科学中心和粮食发酵工艺与技术国家工程实验室陈坚院士团队刘松副教授课题组的研究成果“Significantly Improving the Thermostability and Catalytic Efficiency of Streptomyces mobaraenesis Transglutaminase through Combined Rational Design” (Wang et al., J. Agric. Food Chem., 2021, 69,15268-15278)。2018级博士生王兴隆为论文第一作者,陈坚教授和刘松副教授为通讯作者,论文作者还包括堵国成教授和周景文教授。
谷氨酰胺转氨酶 (Transglutaminase, TGase, EC 2.3.2.13) 能够催化蛋白质及小分子间发生共价交联,被广泛应用于食品的质构改良。近年来, TGase在制药、纺织及皮革等非食品领域展现出广阔的应用前景。由于茂原链霉菌 (Streptomyces mobaraensis) 来源的TGase具有高催化活性等优势,已经成为商品化TGase的主要来源。然而,随着应用领域的拓展,热稳定性不高成为S. mobaraensis TGase高效应用的主要限制性因素。分子改造提高TGase的热稳定性一直是国内外研究的热点。此前,已报道的热稳定性最高的S. mobaraensis TGase突变体S2P-S23V-Y24N-S199A-K294L(TGm1) 在60 ℃条件下半衰期仍仅为21min,远不能满足应用需求。
针对上述问题,江南大学食品合成生物学与生物制造团队开发和组合了一系列酶理性改造方法,使S. mobaraensis TGase热稳定性和催化活性得到显著提升。首先,开发了自动化脚本,实现了基于Rosetta_Cartesian_ddg的脯氨酸扫描,根据虚拟突变体的折叠能变筛选得到热稳定性及催化活性提高的突变体A265P-A287P。其次,构建高精度的酶-底物分子模拟结构,对催化活性基团Cys64 15 Å范围内的残基进行虚拟饱和突变;基于酶-底物复合物(Discovery Studio) 和酶分子个体(Rosetta_Cartesian_ddg)折叠自由能变分析,筛选得到催化活性明显提高且热稳定性不发生明显变化的突变体E28T。最后,应用RosettaSupercharge预测可提高酶分子表面电荷、强化酶分子间静电斥力的突变;结合突点位置、文献检索和折叠自由能变分析(Rosetta_Cartesian_ddg) 压缩突变范围,最后得到热稳定性提高的突变体N96E-S144E-N163D-R183E-R208E-K325E。通过组合上述正向突变获得S. mobaraensis TGase突变体TGm3,其60℃半衰期和比酶活分别达到123 min和84 U/mg,较已报道最高水平分别提高4.8倍和0.5倍。研究得到的高热稳定和催化活性的TGase将有助于拓展该酶在食品及新兴领域的应用。研究开发的酶分子工具包(如单点、多位点扫描及批量传入多种Rosetta模块的脚本等)正逐步完善,近期将分享至Github,为其它酶分子的热稳定性和催化活性的改造提供参考。
上述研究工作得到了国家重点研发计划项目(2021YFC2101400)、国家自然科学基金(32071474;31771913)、国家轻工技术与工程一流学科自主课题(LITE2018-08)等项目的资助。
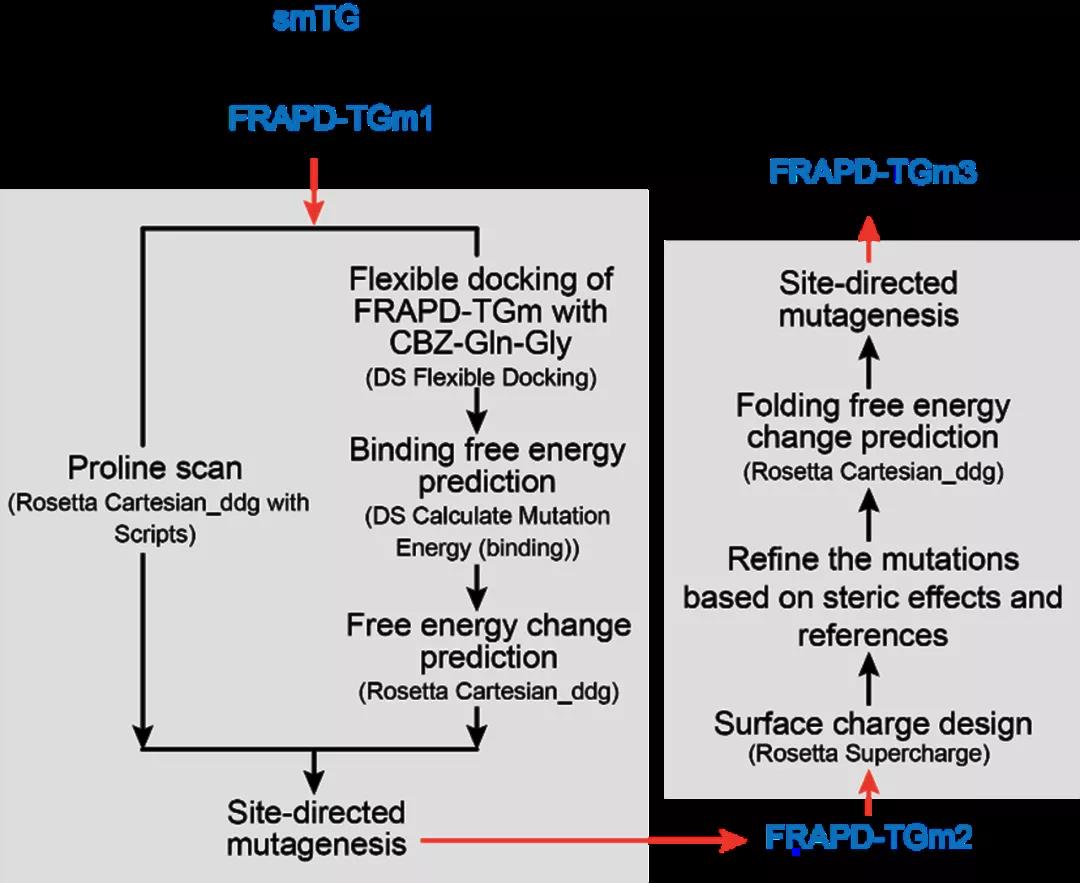
图1 S. mobaraensis TGase理性改造的技术路线
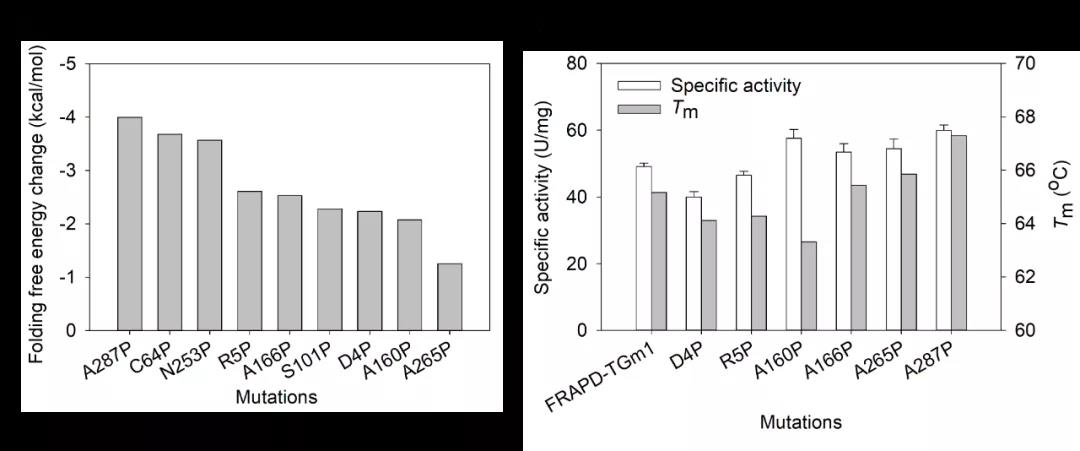
图2 基于脯氨酸扫描的热稳定性改造
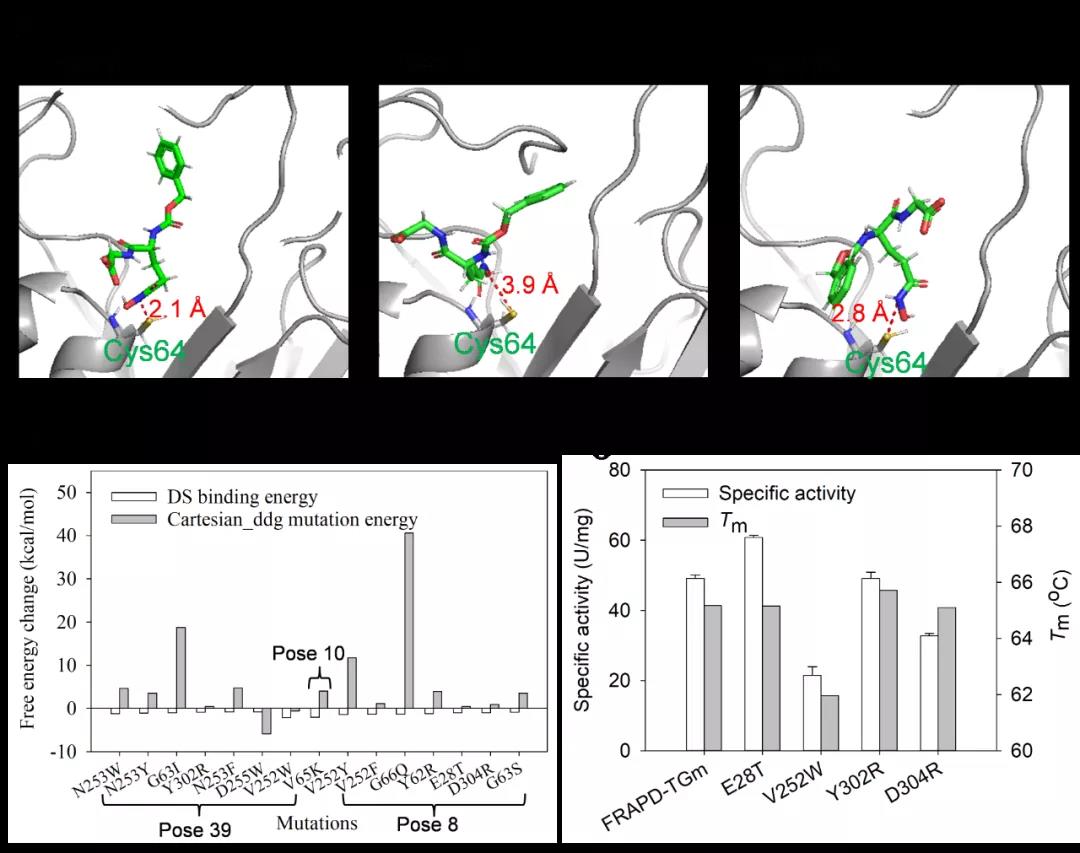
图3 基于酶-底物结合自由能调控的催化活性改造
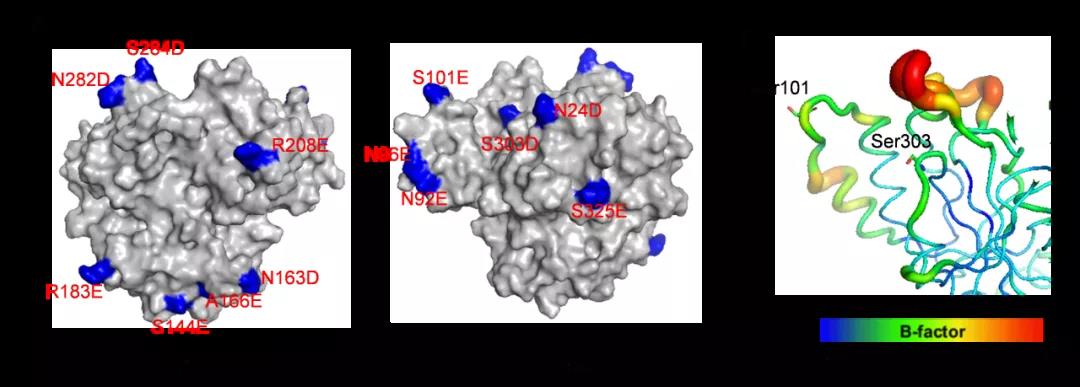
图4 基于酶表面电荷调控的热稳定性改造
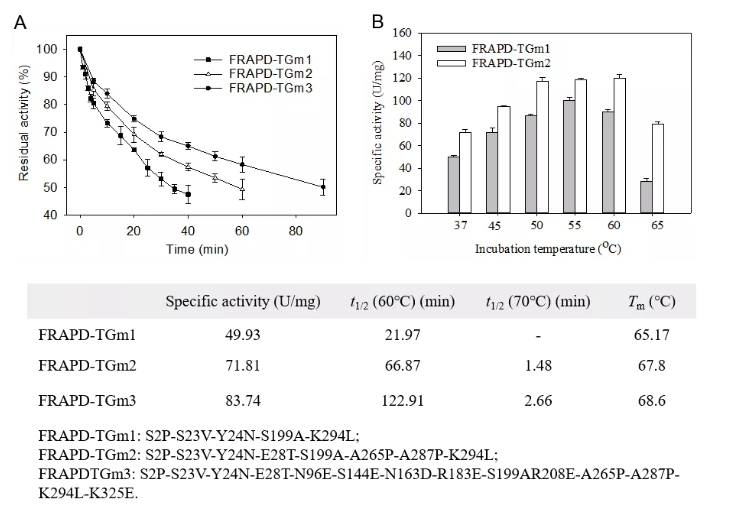
图5 S. mobaraensis TGase主要突变体的性质分析
