合成生物学和代谢工程的主要目标是设计和构建能利用可再生的生物质资源高效合成包括化学品、生物燃料、功能营养品和生物材料在内的多种高价值产品的微生物细胞工厂。传统的静态代谢工程策略如启动子或RBS的替换及竞争性途径的敲除与弱化,容易引起代谢失衡、有毒中间代谢物积累及细胞生长受损等问题。代谢途径的动态调控策略可以在提高产物合成能力的同时动态协调相关代谢网络的流量分布从而避免上述问题的发生,因此其在近年来受到了人们的广泛关注。但目前想要同时实现不同代谢模块的自发动态上调与下调仍具有很大的挑战。
为解决上述难题,江南大学生物工程学院生物系统与生物加工工程研究室研究人员在模式工业微生物枯草芽孢杆菌(Bacillus subtilis)中设计并构建了一个基于生物传感器-CRISPRi合成基因回路的代谢流量动态自发双重调控(autonomous dual-control, ADC)系统,并成功将其应用于功能营养品N-乙酰氨基葡萄糖(GlcNAc)合成相关代谢网络的优化调控中。首先,利用枯草芽孢杆菌中与氨基葡萄糖分解代谢相关的转录因子GamR的调控机制,设计并创制了14个可以响应胞内6-磷酸氨基葡萄糖(GlcN6P)的生物传感器。随后通过将该生物传感器与基于CRISPRi的逻辑“非”门进行耦合,构建了一种可同时对不同代谢模块进行动态自发上调与下调的ADC系统,并使用流式细胞仪对该系统进行了功能验证。然后利用该系统构建了一个反馈调节回路,来同时动态激活GlcNAc合成途径和动态抑制其主要的3个竞争途径(糖酵解途径、磷酸戊糖途径和肽聚糖合成途径)。在该反馈回路的调控作用下,当胞内的GlcN6P出现积累时,会促进GlcN6P流向GlcNAc合成途径;同时也会对上述竞争途径产生弱化作用,从而进一步增加流向GlcN6P的代谢流。通过组装不同强度的激活模块与抑制模块,最终实现了GlcNAc合成的动态平衡与最优调控,GlcNAc的摇瓶产量由18.3 g/L提高到了28.0 g/L;而且此时细胞生长受到的影响也较小,副产物乙偶姻也较出发菌株有所降低。最后,在15-L发酵罐上对该反馈回路的稳定性进行了验证,通过补料分批发酵GlcNAc产量达到了131.6 g/L,为目前文献报道的最高水平。
上述研究工作得到了国家重点研发计划(2018YFA0900300)、国家自然科学基金(31622001, 31671845, 31600068, 31930085)、中央高校基本科研专项资金(JUSRP51713B)、江苏省自然科学基金(BK20160176)、111项目(111-2-06)和江苏省研究生科研创新计划(KYCX18 1802)的资助,以“Design of a programmable biosensor-CRISPRi genetic circuits for dynamic and autonomous dual-control of metabolic flux in Bacillus subtilis”发表在期刊Nucleic Acids Research上(Wu et al., Nucleic Acids Res. 2020. 48: 996-1009)。2017级博士生武耀康为论文第一作者,刘龙教授为通讯作者。
图1 基于6-磷酸氨基葡萄糖(GlcN6P)生物传感器的可编程合成基因回路的设计及其在N-乙酰氨基葡萄糖(GlcNAc)合成中的应用
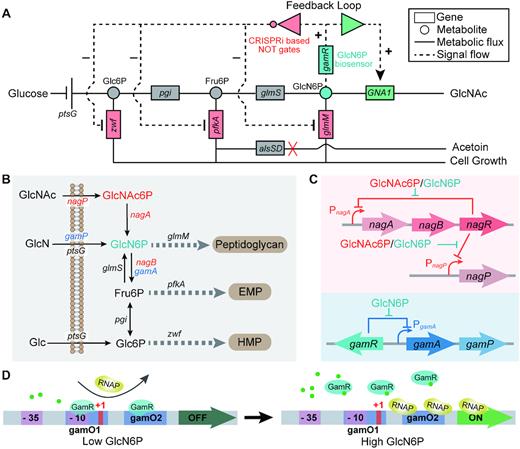

图1 基于6-磷酸氨基葡萄糖(GlcN6P)生物传感器的可编程合成基因回路的设计及其在N-乙酰氨基葡萄糖(GlcNAc)合成中的应用


