重组毕赤酵母组成型高效表达水蛭透明质酸酶
发布于 2020-05-12 15:18:36 来源
LBBE
透明质酸酶(HAase)是催化透明质酸降解的一类糖苷酶,已广泛应用于医药领域。透明质酸的生物学功能在很大程度上取决于其链长,其中低分子量透明质酸(<100,000 Da)及透明质酸寡糖(<10,000 Da)具有独特的生物学活性,例如诱导血管生成,促进伤口愈合以及抑制肿瘤迁移等。相比物理和化学降解法制备低分子量透明质酸,酶促降解法反应条件温和,不破坏透明质酸分子结构,具有广阔的前景。水蛭透明质酸酶(LHyal)特异性水解β-1,3糖苷键,底物专一性强,不具有转糖苷活性,水解产物分子量分布范围窄,对于制备低分子量透明质酸及应用临床治疗(外科、眼科和内科)更具价值。尽管利用甲醇诱导型启动子(PAOX1),LHyal已在毕赤酵母中实现了高效表达,但甲醇具有毒性,作为诱导剂加入发酵液后可能在产物中残留,且其属于易燃易爆物,给安全生产带来隐患。
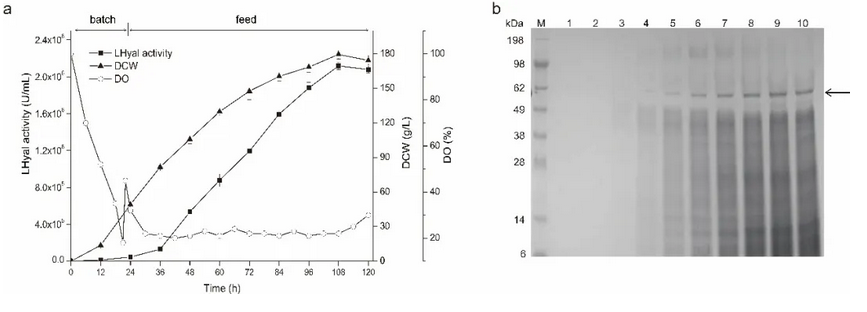
针对此问题,江南大学生物工程学院生物系统与生物加工工程研究室研究人员利用组合策略在毕赤酵母中实现了LHyal的高水平组成型表达,避免了发酵过程中甲醇的添加。首先,通过优化组成型启动子 PGAP,PGAP( m ) 和 PTEF1 与信号肽 α-factor,nsB和sp23的组合,摇瓶中胞外LHyal的酶活达到1.38 × 105U/mL。接着,尝试在LHyal的N端融合带不同电荷的氨基酸标签来促进蛋白的表达,发现融合6个谷氨酰胺后,LHyal酶活明显提高,达到2.06 × 105U/mL。进一步,分析了三种不同的转录因子( Aft1 ,Gal4-like ,Yap1 )对于LHyal 分泌表达的影响。其中,当共表达负责调节碳代谢基因的转录因子Aft1 时, LHyal酶活提高了47.1% 。将重组菌株连续传代20次,酶活无变化,表明毕赤酵母良好的遗传和表达稳定性。最后,在3-L 发酵罐中高密度培养重组菌株,过程中连续流加甘油, LHyal酶活达到2.12 × 106 U/mL,是摇瓶水平的7倍,且生产率提高至1.96 × 104 U/mL/h ,明显高于诱导型表达。
上述研究工作得到了江苏省重点技术研发项目基金(BE2019630)、国家自然科学基金(31670092)、中央高校基础研究经费(JUSRP51707A)和国家轻工业技术与工程一流学科计划(LITE2018-16)的资助,以 “High-level constitutiveexpression of leech hyaluronidase with combined strategies in recombinant Pichiapastoris” 发表在期刊 AppliedMicrobiology and Biotechnology 上( Huang et al.,2020, Applied Microbiology and Biotechnology, 104(4): 1621-1632 ),2017 级博士生黄浩为论文第一作者,陈坚教授和康振教授为通讯作者。
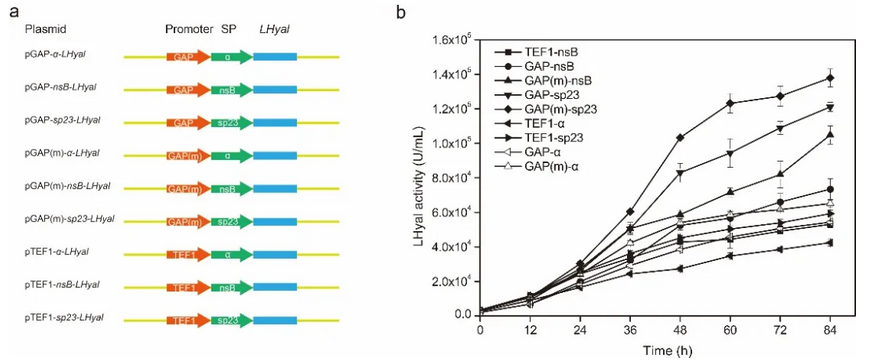
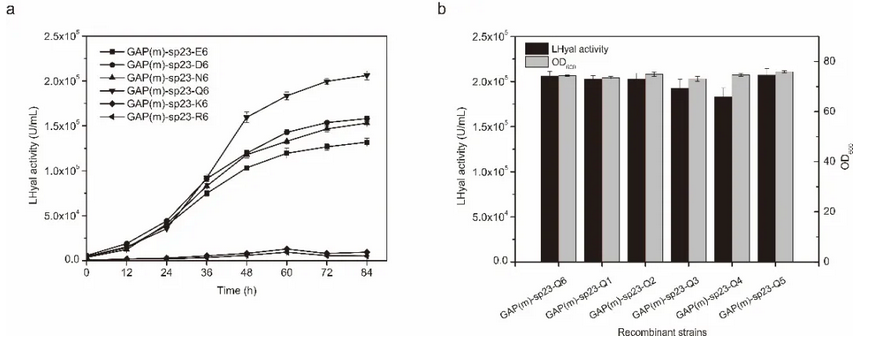
图3 过表达转录因子对LHyal酶活及细胞生长的影响
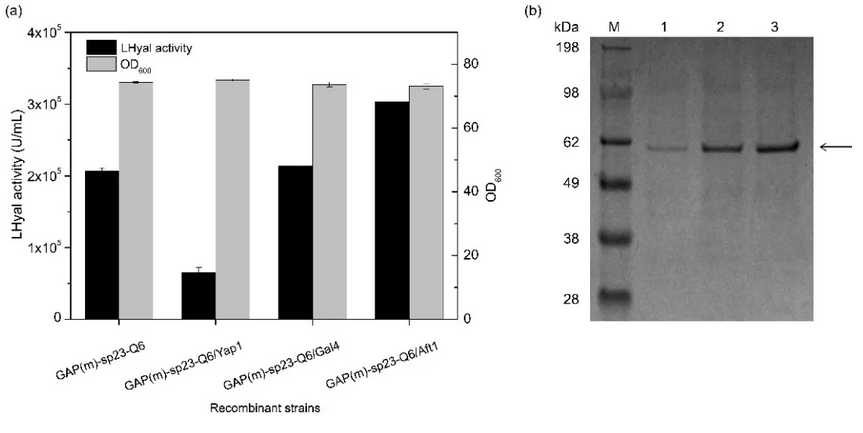
图4 3-L罐分批补料发酵重组菌株GAP(m)-sp23-Q6/Aft1