近日,Metabolic Engineering在线发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队刘龙教授课题组的研究成果“Combinatorial pathway engineering of Bacillus subtilis for production of structurally defined and homogeneous chitooligosaccharides”(Ling et al., Metabolic Engineering. 2022. 70:55-66)。江南大学2022级博士后凌美希为论文第一作者,刘龙教授和堵国成教授为通讯作者。
几丁质和壳聚糖具有广泛的生物活性,但由于难溶于水,其应用受到限制;而作为几丁质和壳聚糖的寡聚物,甲壳低聚糖(chitooligosaccharides, COSs)则易溶于水,可被广泛应用于医药、食品和农业等领域。根据结构特征,COSs可被划分为壳寡糖(CSOSs)和几丁质寡糖(CTOSs),不同结构的COSs具有不同的生物功能。目前,COSs的合成方法主要包括化学合成法、化学降解法、物理降解法和生物酶降解法,然而使用这些方法所得到的产物均为结构特征不够明确的COSs混合物,限制了COSs的功能研究及应用,因此,亟需开发一种新技术或新方法用以生产具有明确结构特征的COSs。
针对上述问题,江南大学食品合成生物学与生物制造团队利用组合途径工程实现了CTOSs在枯草芽孢杆菌(Bacillus subtilis)中的从头合成。首先,通过在B. subtilis中表达外源COSs合成酶NodC,成功构建了CTOSs合成途径,实现CTOSs在B. subtilis中的积累;进一步对其结构进行鉴定,结果显示CTOSs的组成成分为CTOS2、CTOS3、CTOS4和CTOS5;随后,为了明确CTOSs每个单体的产量分布情况,研究者建立了CTOSs单体定量方法,并优化了发酵培养基的关键组分,发现当选择优化过的无机盐培养基C作为发酵培养基时,菌株生产的CTOSs主要为单体CTOS5,且产量达到71.6 mg/L;之后,考虑到GlcNAc不能在B. subtilis野生菌中过量积累,本研究设计并构建了三种具有不同GlcNAc合成强度的重组菌株,发现随着GlcNAc合成强度的增加,CTOSs产量逐渐降低,说明相比于GlcNAc,NodC和UDP-GlcNAc可能是CTOSs合成的关键因素。随即研究人员优化了NodC的来源和表达量,发现来源于Mesorhizobium loti的nodCM用高拷贝质粒pP43NMK表达时,CTOSs产量最高,达到560 mg/L,进一步对另一个关键因素UDP-GlcNAc的合成途径进行系统优化,通过工程化改造并比较UDP-GlcNAc的从头合成途径和回补途径,CTOSs产量提高到2.34 g/L;最后,将最优重组菌株在3-L罐上进行补料分批发酵,CTOSs产量达到4.82 g/L,CTOS5、CTOS4、CTOS3和CTOS2的占比分别为85.6%、7.5%、5.3%和1.6%,为目前文献报道的最高水平。该研究证明了通过合成生物学从头合成结构明确的CTOSs的可行性,为进一步工程改造以实现其商业化生产奠定了良好的基础。
上述研究工作得到了国家自然科学基金(32021005, 31930085)、国家重点研发计划(2018YFA0900300,2018YFA0900504)、中央高校基本科研业务费专项资金资助(JUSRP52019A)、山东省重大科技创新项目(2019JZZY011002)等的资助。
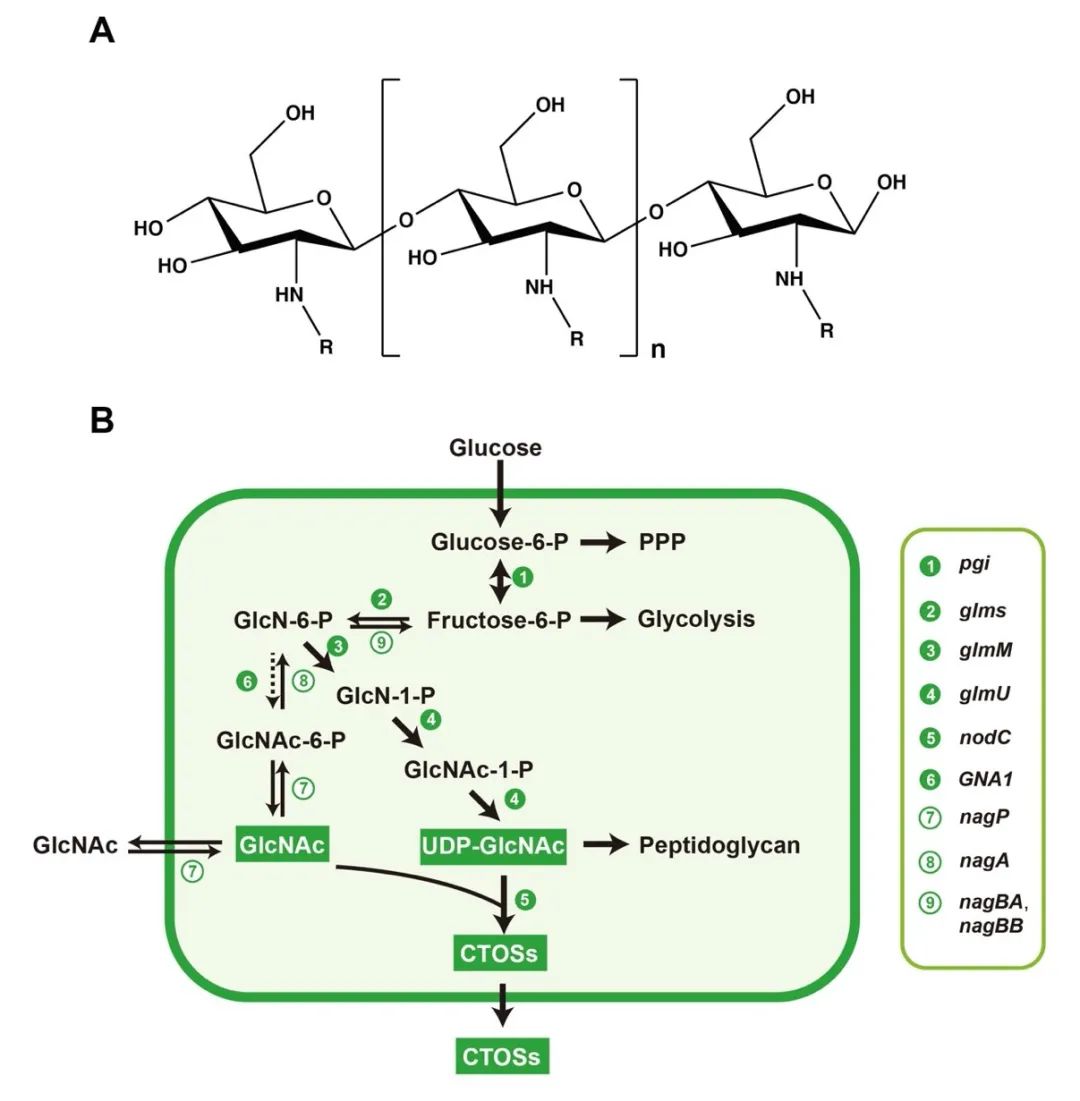
图1 CTOSs化学结构式(n=2-8, R=-OH3)及其在B. subtilis中的代谢途径
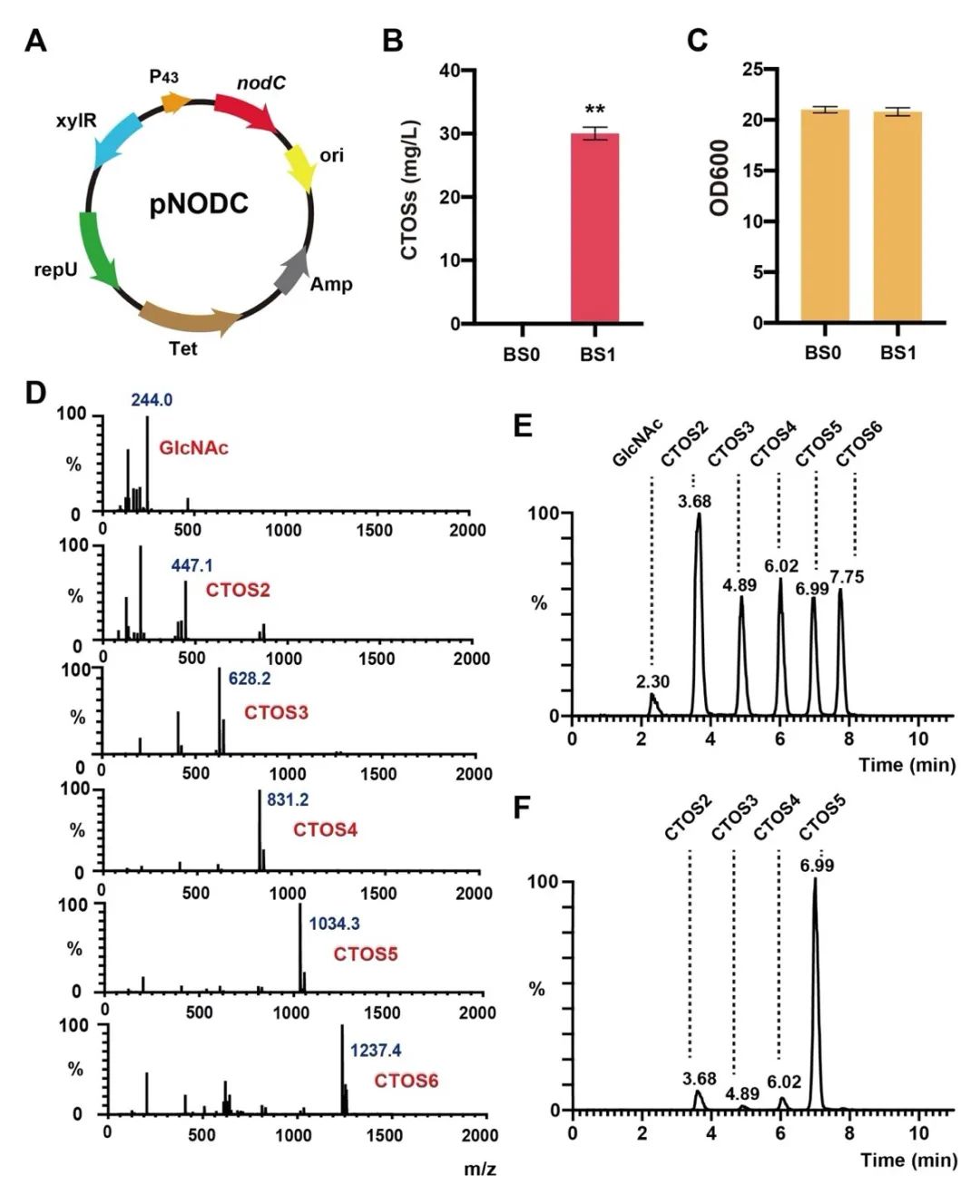
图2 在B. subtilis中表达nodC合成结构特征明确的CTOSs
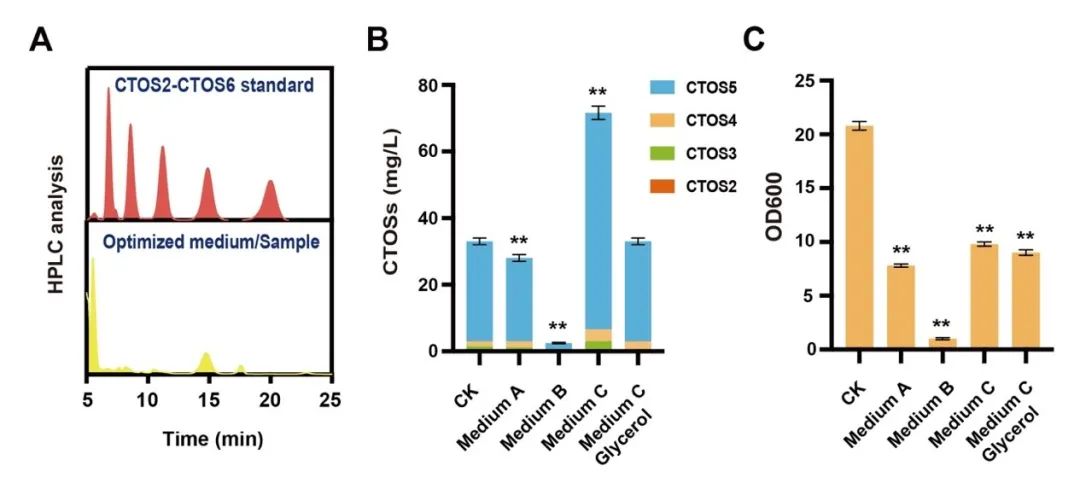
图3 发酵培养基优化促进CTOSs合成
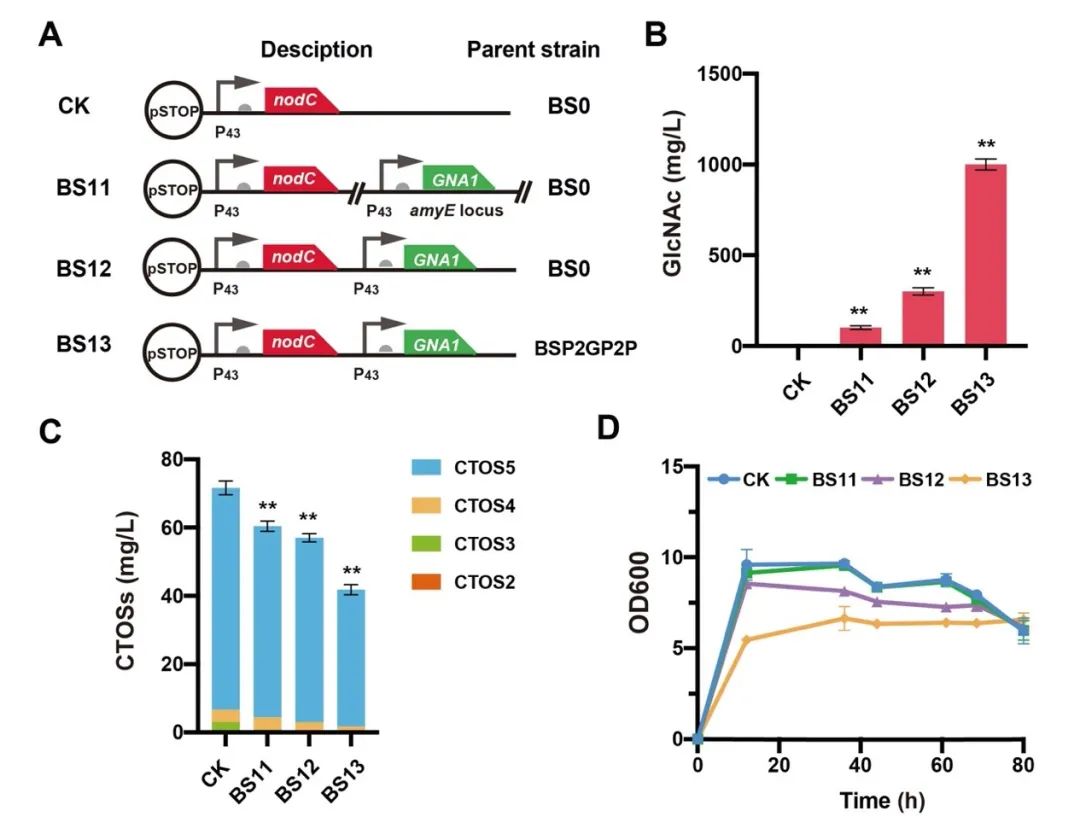
图4 在B.subtilis中引入GlcNAc合成模块促进糖基受体GlcNAc的积累
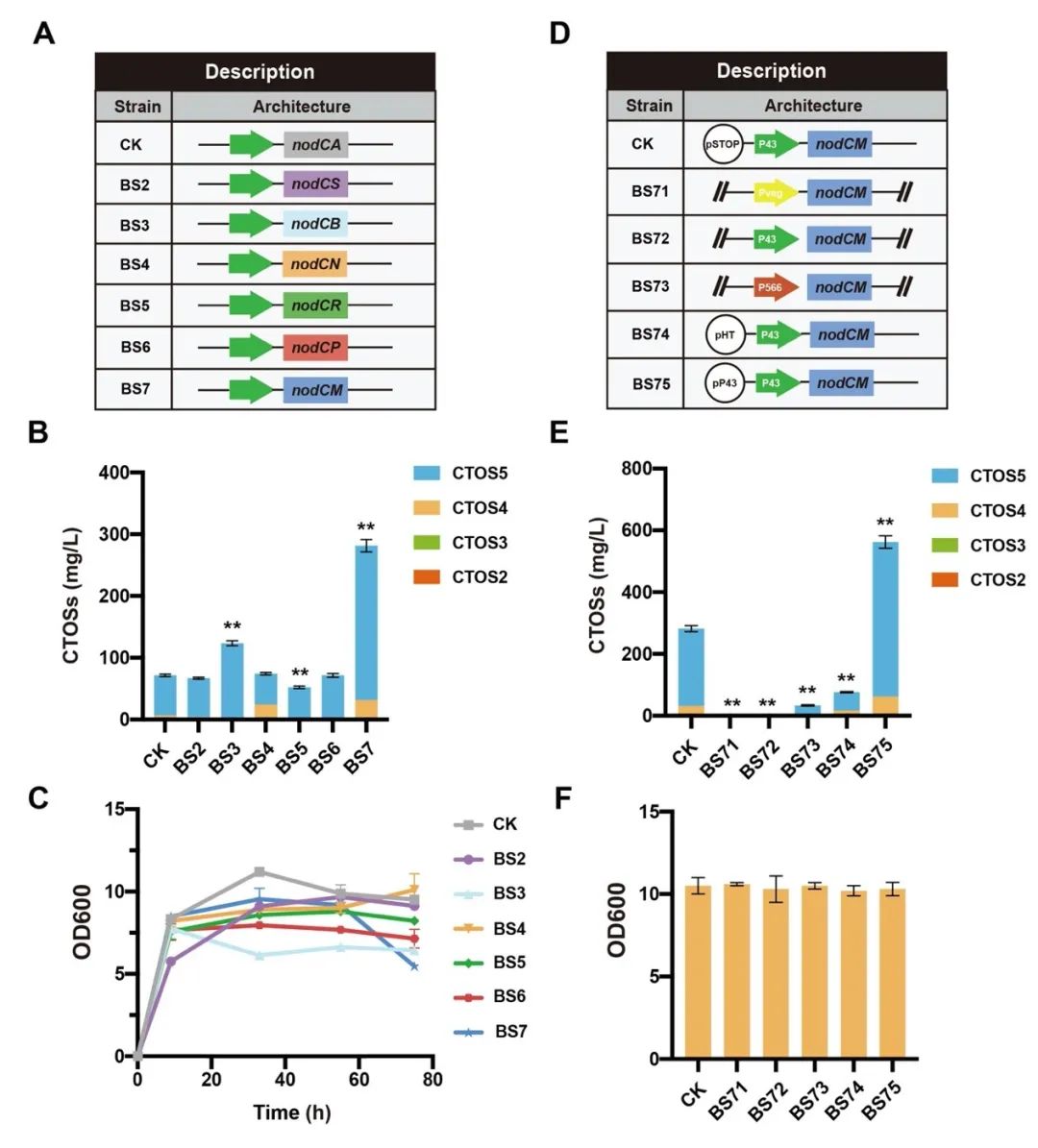
图5 优化COSs合成酶提高CTOSs产量

图6 优化糖基供体UDP-GlcNAc合成途径提高CTOSs产量
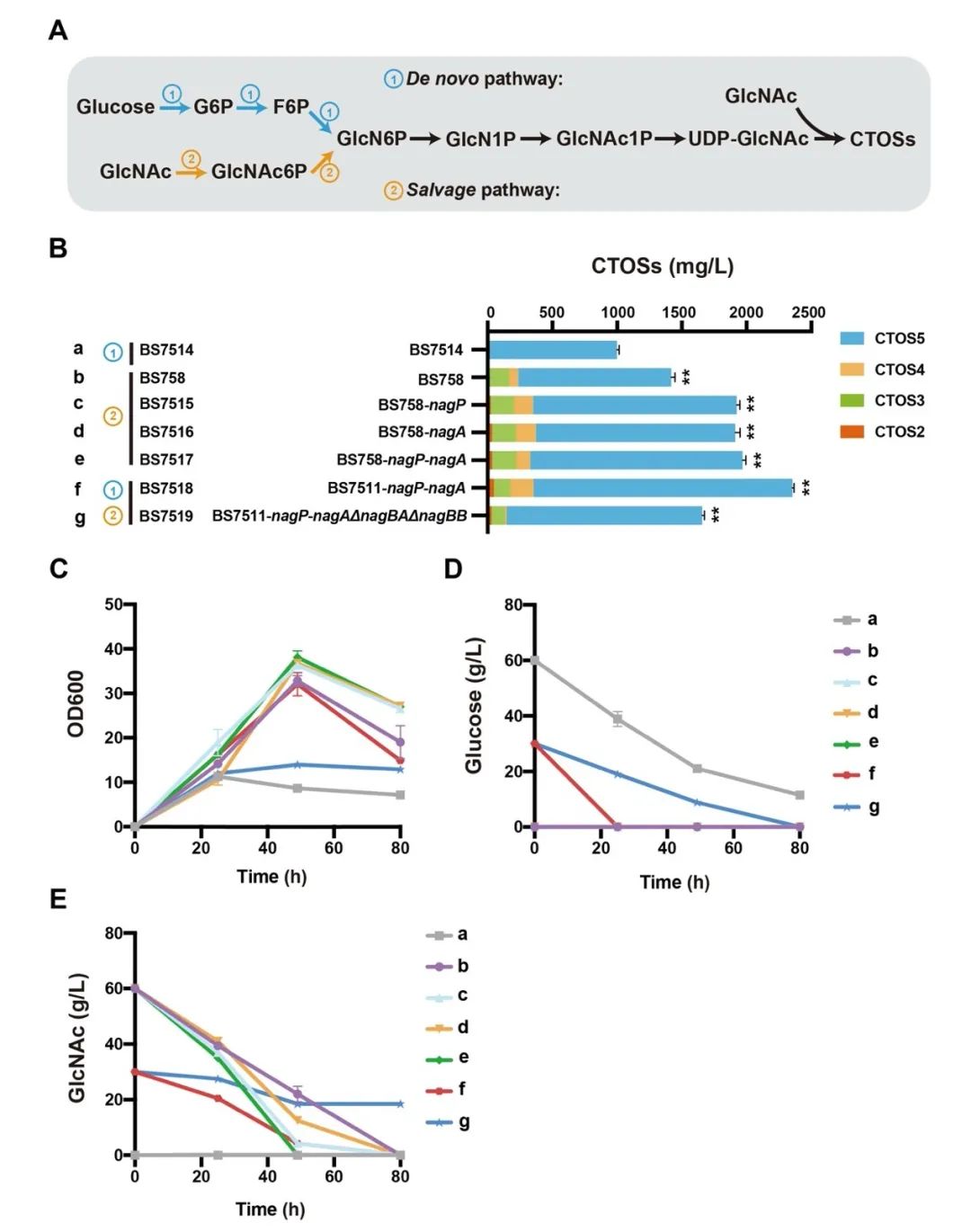
图7 比较UDP-GlcNAc的从头合成途径和回补途径
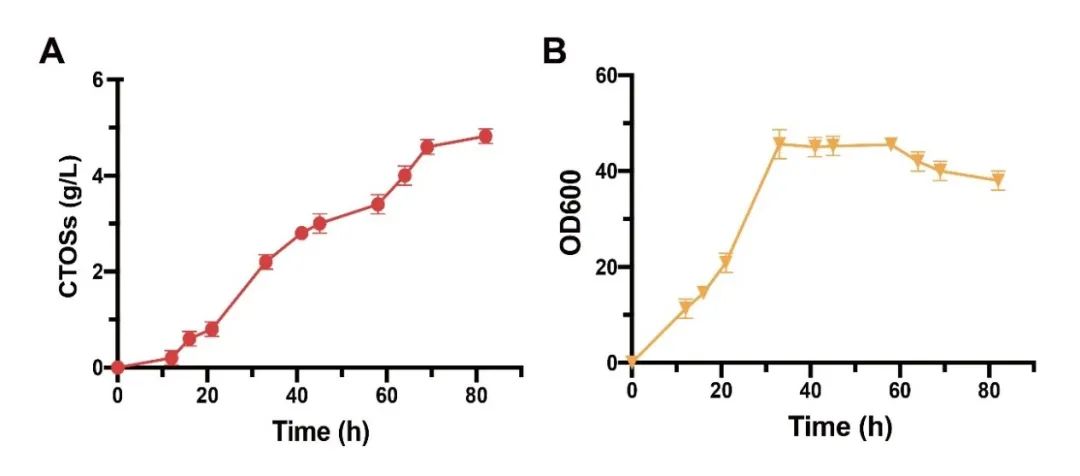
图8 3-L罐补料分批发酵
